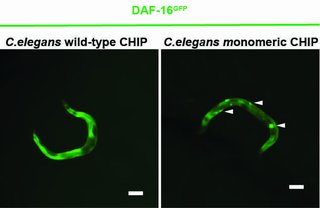
Eine neue Studie zeigt, dass das Protein CHIP alleine wesentlich effizienter den Insulinrezeptor hemmen kann als in einem sonst üblichen Verbund. CHIP ist in zellulären Stresssituationen in der Regel als Dimer - einem Verbund von zwei gekoppelten Proteinen - vor allem für den Abbau von falsch gefalteten Proteinen zuständig. CHIP räumt also die Zelle auf. Hierfür markiert CHIP Proteine mit einer Kette aus kleinen Eiweißen, dem Ubiquitin. Gemeinsam mit Helferproteinen werden defekte Proteine so von der Zelle erkannt und entsorgt. Eine weitere Funktion ist die Regulierung der Signalübertragung des Insulinrezeptors. CHIP bindet den Rezeptor, wirkt so als Bremse, und stoppt die Signalübertragung. Bestimmte Gene können so nicht aktiviert werden, was die Lebensspanne verlängert. Ein Kölner Forschungsteam hat nun durch Experimente mit dem Fadenwurm Caenorhabditis elegans und menschlichen Zellen gezeigt, dass CHIP sich selbst mit Ubiquitin markieren kann, was die Dimer-Bildung verhindert. CHIP bleibt als sogenanntes Monomer allein und kann in dieser Formation seine Funktion als Bremse des Insulinsignalweges besser ausüben als im Dimer-Verbund. Die Studie der Wissenschaftler*innen um Prof. Dr. Thorsten Hoppe vom Exzellenzcluster CECAD für Alternsforschung wurde unter dem Titel „A Dimer-Monomer Switch Controls CHIP-Dependent Substrate Ubiquitylation and Processing“ in Molecular Cell veröffentlicht.
„Ob CHIP alleine oder im Team arbeitet, wird vom Zustand der Zelle bestimmt. Wenn zu viele fehlerhaft gefaltete Proteine vorliegen und auch zu viele Helferproteine vorhanden sind, wird die Autoubiquitinierung, also die Selbstmarkierung mit Ubiquitin, verhindert. CHIP muss zunächst Ordnung schaffen“, sagt Vishnu Balaji, Erstautor der Studie. „Nach erfolgreichem Aufräumen der fehlerhaften Proteine kann CHIP auch die Helferproteine markieren und zum Abbau bringen“, erklärt der Wissenschaftler. Damit der Körper reibungslos funktionieren kann, muss also ein Gleichgewicht zwischen dem monomeren und dimeren Zustand von CHIP bestehen. „Interessant ist, dass das Monomer-Dimer Gleichgewicht von CHIP in Krankheiten gestört zu sein scheint“, sagt Prof. Dr. Thorsten Hoppe. „Bei Spinozerebellären Ataxien, einer neurodegenerativen Krankheit, sind beispielsweise verschiedene Stellen des Proteins mutiert und CHIP arbeitet bevorzugt als Dimer. Hier wäre eine Verschiebung zu mehr Monomeren ein möglicher therapeutischer Ansatz.“ Im nächsten Schritt wollen die Wissenschaftler*innen herausfinden, ob es noch mehr Proteine oder Rezeptoren gibt, an die das CHIP-Monomer bindet, und somit deren Funktion reguliert. Zudem interessiert die Forscher*innen, in welchen Geweben und Organen und in welchen Erkrankungen vermehrt CHIP Mono- oder Dimere vorliegen, um in Zukunft gezieltere Therapien entwickeln zu können.
Inhaltlicher Kontakt:
Professor Dr. Thorsten Hoppe
+49 221 478 84218
thorsten.hoppeuni-koeln.de
Presse und Kommunikation:
Dr. Anna Euteneuer
+49 221 470 1700
a.euteneuerverw.uni-koeln.de
Publikation:
Balaji V, Müller L, Lorenz R, Kevei E, Zhang WH, Santiago U, Gebauer J, Llamas E, Vilchez D, Camacho CJ, Pokrzywa W, Hoppe T. A Dimer-Monomer Switch Controls CHIP-Dependent Substrate Ubiquitylation and Processing. Mol Cell. 2022
https://www.cell.com/molecular-cell/fulltext/S1097-2765(22)00756-0