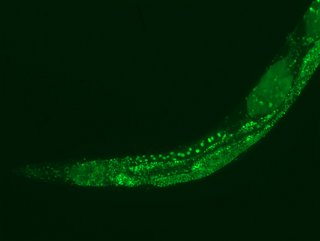
Kälte aktiviert einen zellulären Reinigungsmechanismus, der schadhafte, für verschiedene altersbedingte Erkrankungen verantwortliche Proteinaggregationen abbaut. Dass die Lebenserwartung deutlich steigt, wenn die Körpertemperatur abgesenkt wird, zeigten bereits in den vergangenen Jahren Untersuchungen an verschiedensten Modellorganismen. Wie das allerdings genau funktioniert, ist in vielen Bereichen noch weitgehend unklar. Ein Team des Alternsforschungs-Exzellenzclusters CECAD der Universität zu Köln entschlüsselte nun einen Mechanismus, der ein Erklärmodell dafür liefert. Die Studie ist unter dem Titel „Cold temperature extends longevity and prevents disease-related protein aggregation through PA28γ-induced proteasomes“ in der Fachzeitschrift Nature Aging erschienen.
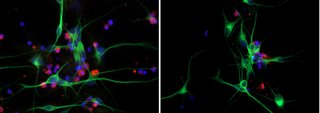
Professor Dr. David Vilchez und seine Arbeitsgruppe nutzten dafür einen wirbellosen Modellorganismus, den Fadenwurm Caenorhabditis elegans, und kultivierten menschliche Zellen. Beide trugen die Gene für zwei neurodegenerative Erkrankungen in sich, die typischerweise im Alter auftreten: die Amyotrophe Lateralsklerose (ALS) und die Huntington-Krankheit. Beide Krankheitsbilder zeichnen sich durch Ansammlungen von schadhaften und schädlichen Eiweißablagerungen aus, die sogenannten pathologischen Proteinaggregationen. Kälte führte in beiden Modellorganismen dazu, dass die zur Verklumpung neigenden Proteine aktiv entfernt wurden und die für ALS und Huntington pathologische Proteinaggregation verhindert wurde.
Im Detail untersuchte das Team, ob Kälte die Proteasomaktivität beeinflusst. Dieser zelluläre Mechanismus beseitigt beschädigte Proteine in den Zellen. Die Untersuchungen zeigten, dass der Proteasomaktivator PA28γ/PSME3 die altersbedingten Defizite sowohl im Fadenwurms als auch in menschlichen Zellen abschwächt. In beiden Fällen war es möglich, die Proteasomaktivität durch eine moderate Temperaturabsenkung zu aktivieren. „Zusammengenommen zeigen die Ergebnisse eine evolutionär konservierte Wirkung von Kälte bei der Proteasomregulierung mit therapeutischen Ansatzpunkten für das Altern und altersbedingte Krankheiten“, sagt Professor Vilchez.
Das Altern ist ein Hauptrisikofaktor für verschiedene neurodegenerative Erkrankungen, die mit der Proteinaggregation verbunden sind, einschließlich Alzheimer, Parkinson, Huntington und ALS. Professor Vilchez sagt: „Wir glauben, dass sich diese Ergebnisse auch auf weitere alterstypische neurodegenerative Erkrankungen übertragen lassen, wie auch auf andere Tierarten.“ Eine zentrale Erkenntnis der Forschenden ist es, dass sich die Aktivität des Proteasomaktivators auch durch genetische Überexpression erhöhen lasst. So können krankheitsverursachende Proteine selbst bei normaler Temperatur von 37 Grad Celsius eliminiert werden. Daraus ergeben sich mögliche Ansatzpunkte für therapeutische Eingriffe beim Altern und altersbedingten Erkrankungen.
Es ist seit langem bekannt, dass extrem niedrige Temperaturen zwar für den Organismus schädlich sein können, eine moderate Senkung der Körpertemperatur jedoch sehr positive Auswirkungen haben kann. So verlängert eine niedrigere Körpertemperatur die Langlebigkeit sowohl bei sogenannten wechselwarmen Tieren, deren Körpertemperatur mit der Umgebungstemperatur schwankt, also etwa bei Würmern, Fliegen oder Fischen. Aber dasselbe Phänomen tritt auch bei gleichwarmen Tieren wie Säugetieren auf, die ihre Körpertemperatur in einem engen Temperaturbereich halten können, egal wie kalt oder warm es in ihrer Umgebung ist. Zum Beispiel lebt der Fadenwurm viel länger, wenn er von der Standardtemperatur von 20 Grad Celsius auf eine kältere Temperatur von 15 Grad Celsius umgestellt wird. Und bei Mäusen verlängert eine leichte Abnahme der Körpertemperatur um lediglich 0,5 Grad Celsius ihre Lebensdauer erheblich. Das stützt die Annahme, dass die Temperatursenkung bei der Langlebigkeit eine zentrale Rolle im Tierreich spielt und ein sehr gut konservierter Mechanismus ist.
Selbst beim Menschen wird von einer Korrelation zwischen Körpertemperatur und Lebensdauer berichtet. Die normale menschliche Körpertemperatur liegt zwischen 36,5 und 37 Grad Celsius. Während ein akutes Absinken der Körpertemperatur unter 35 Grad Celsius zu Unterkühlung führt, schwankt die Körpertemperatur des Menschen tagsüber leicht und erreicht im Schlaf sogar kühle 36 Grad Celsius. Interessanterweise berichtete eine frühere Studie, dass die menschliche Körpertemperatur seit der industriellen Revolution kontinuierlich um 0,03 Grad Celsius pro Jahrzehnt gesunken ist, was auf einen möglichen Zusammenhang mit der fortschreitenden Zunahme der menschlichen Lebenserwartung in den letzten 160 Jahren hindeutet.
Die Studie wurde am Alternsforschungs-Exzellenzcluster CECAD der Universität zu Köln durchgeführt.
Inhaltlicher Kontakt:
Professor Dr. David Vilchez
CECAD Arbeitsgruppenleiter
+49 221 478 84172
dvilchezuni-koeln.de
Presse und Kommunikation:
Susanne Kutter
CECAD Public Relations Officer
+49 221 478 84043
+49 160 8879816
susanne.kutteruni-koeln.de
Veröffentlichung:
Hyun Ju Lee, Hafiza Alirzayeva, Seda Koyuncu, Amirabbas Khodakarami, Alireza Noormohammadi, David Vilchez
Cold temperature extends longevity and prevents disease-related protein aggregation through PA28γ-induced proteasomes, Nature Aging, 3. April 2023
https://www.nature.com/articles/s43587-023-00383-4
Weitere Informationen:
Alternsforschungs-Exzellenzcluster CECAD
Webseite Prof. Dr. David Vilchez