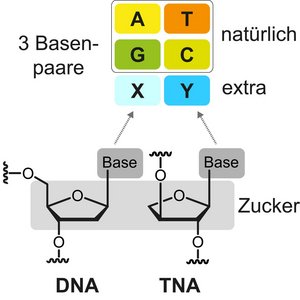
Die DNA, die die Erbinformation aller Lebewesen trägt, besteht aus nur vier verschiedenen Bausteinen, den Nukleotiden. Der klassische Aufbau dieser Nukleotide ist dreigeteilt: eine Zuckergruppe, eine Phosphatgruppe, sowie eine der vier Nukleobasen Adenin, Thymin, Guanin und Cytosin. Die Nukleotide sind millionenfach aneinandergereiht und bilden durch ihre Verbindungen die DNA-Helix-Struktur, ähnlich einer Wendeltreppe. Kölner Wissenschaftlerinnen des Departments für Chemie haben nun gezeigt, dass die Struktur der Nukleotide im Labor stark verändert werden kann. Die Forschenden entwickelten sogenannte Threonukleinsäuren (TNA) mit einem neuen, zusätzlichen Basenpaar. Dies sind die ersten Schritte auf dem Weg zu völlig künstlichen Nukleinsäuren mit erweiterten chemischen Funktionalitäten. Die Studie wurde unter dem Titel „Expanding the Horizon of the Xeno Nucleic Acid Space: Threose Nucleic Acids with Increased Information Storage“ in der Fachzeitschrift Journal of the American Chemical Society veröffentlicht.
Künstliche Nukleinsäuren unterscheiden sich im Aufbau zu ihren Originalen. Diese Veränderungen haben Auswirkungen auf Stabilität und Funktion der Nukleinsäuren. "Unsere Threonukleinsäure ist stabiler als die natürlich vorkommenden Nukleinsäuren DNA und RNA, was viele Vorteile für künftige therapeutische Nutzung bringt“ sagt Professorin Dr. Stephanie Kath-Schorr. Für die Studie wurde der 5-Fach Zucker Desoxyribose, der das Rückgrat in DNA bildet, durch einen 4-Fach Zucker ausgetauscht. Zusätzlich wurde die Anzahl der Nukleobasen von vier auf sechs erhöht. Durch den Austausch des Zuckers wird die TNA nicht von den zelleigenen Abbauenzymen erkannt. Dies war bisher ein Problem bei Nukleinsäure-basierten Therapeutika, da synthetisch hergestellte RNA, die in eine Zelle geschleust wird, schnell abgebaut wird und ihre Wirkung verliert. Die Einbringung von TNAs in Zellen, die unentdeckt bleiben, könnte die Wirkung nun länger aufrechterhalten. „Außerdem ermöglicht das eingebaute unnatürliche Basenpaar alternative Bindungsmöglichkeiten an Zielmoleküle in der Zelle", ergänzt Hannah Depmeier, Erstautorin der Studie. Kath-Schorr ist sich sicher, dass solch eine Funktion insbesondere Anwendung in der Entwicklung neuer Aptamere, kurzen DNA- oder RNA-Stücken genutzt werden kann, die zur gezielten Steuerung zellulärer Mechanismen verwendet werden können. Auch für den gezielten Transport von Medikamenten zu bestimmten Organen im Körper (targeted drug delivery) sowie in der Diagnostik könnten TNAs angewendet werden und etwa bei der Erkennung von Virusproteinen oder Krankheitsmarkern nützlich sein.
Inhaltlicher Kontakt:
Prof. Dr. Stephanie Kath-Schorr
Department für Chemie
+49 221 470 4375
skathschuni-koeln.de
Presse und Kommunikation:
Dr. Anna Euteneuer
+49 221 470 1700
a.euteneuer@verw.uni-koeln.de
Veröffentlichung:
https://pubs.acs.org/doi/abs/10.1021/jacs.3c14626