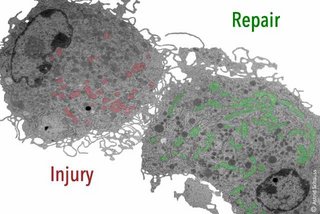
Ein Kölner Forschungsteam hat entdeckt, dass der Stoffwechsel von Mitochondrien, den Energielieferanten der Zellen, in Makrophagen die Wundheilung maßgeblich koordiniert. Makrophagen gehören zu den weißen Blutkörperchen und sind auch als Fresszellen bekannt. Professorin Dr. Sabine Eming und ihre Mitarbeiter:innen und Kolleg:innen am CECAD Exzellenzcluster für Alternsforschung der Universität zu Köln zeigten, dass Wund-Makrophagen während der Gewebereparatur unterschiedliche Stoffwechselprogramme durchlaufen, die zur Unterstützung der aufeinander folgenden Phasen für den Wiederaufbau der Haut nach einer Verletzung erforderlich sind. Der Artikel „Mitochondrial metabolism coordinates stage-specific repair processes in macrophages during wound healing“ wurde jetzt in Cell Metabolism veröffentlicht.
Im menschlichen Körper können Makrophagen verschiedene Aktivierungszustände annehmen. Als pro-entzündliche Makrophagen in der frühen Phase der Wundheilung töten sie Bakterien oder Viren ab und leiten eine schützende Abwehrantwort ein. Reparative Makrophagen der späten Wundheilung unterstützen die Auflösung der Entzündung, damit sich das Gewebe aufbauen und das Gleichgewicht wieder hergestellt werden kann. Eine ungelöste Frage in der Makrophagenbiologie ist, welche Signale für den Übergang von entzündlichen hin zu reparativen Makrophagen nötig sind. In der neuen Studie haben Eming, leitende Oberärztin der Klinik und Poliklinik für Dermatologie und Venerologie sowie Forschungsgruppenleiterin am CECAD und am Zentrum für Molekulare Medizin Köln (CMMC), und ihr Team einen funktionellen Zusammenhang zwischen der Gewebereparatur, dem Zellstoffwechsel sowie der Aktivierung und Funktion von Gewebe-reparativen Makrophagen nachgewiesen. Die Veränderungen im mitochondrialen Stoffwechsel sind der entscheidende Kontrollmechanismus für die unterschiedlichen Funktionen von Makrophagen während der frühen und späten Wundheilung.
Im Tiermodell haben die Wissenschaftler:innen den Stoffwechsel von Makrophagen im frühen und späten Wundheilungszustand untersucht. Sie fanden heraus, dass der Zucker-Stoffwechsel in der frühen Phase nicht ausreicht, um eine produktive Reparatur zu gewährleisten. Mit Hilfe von Einzelzellsequenzierung entdeckte das Team, dass eine Subpopulation von Makrophagen im Frühstadium reaktive Sauerstoffradikale verstoffwechselt, die in den Mitochondrien als Nebenprodukt der Zellatmung entstehen. Eming und das Team konnten erstmalig zeigen, dass der Nutzen der reaktionsfreudigen Sauerstoff-enthaltenden Moleküle in den frühen Wund-Makrophagen essenziell ist, um das Wachstum von Blutgefäßen – und damit eine rechtzeitige Heilung – zu sichern. Im Gegensatz dazu nutzen die Makrophagen für ihre anti-entzündlichen und reparativen Funktionen in der späten Phase der Wundheilung eine andere Art des mitochondrialen Stroffwechsels, der über bestimmte Rezeptoren (IL-4Ra) vermittelt wird.
„Auf der Grundlage unserer Ergebnisse wird es sehr interessant sein zu verstehen, ob gestörter mitochondrialer Stress in Zellen des Immunsystems zu fehlgeleiteten Entzündungsreaktionen in der Haut und pathologischen Wundheilungszuständen beiträgt“, sagt Eming. „Es wird zudem spannend sein zu sehen, ob ein pharmakologisches Eingreifen in die mitochondriale Stressreaktionen einen therapeutischen Nutzen darstellt und die Reparatur von verletztem Gewebe erleichtert.“
Inhaltlicher Kontakt:
Professor Dr. Sabine Eming
+49 221 478 3196
sabine.eminguni-koeln.de
Presse und Kommunikation:
Dr. Anna Euteneuer
+49 221 478 84043
anna.euteneueruni-koeln.de
Veröffentlichung:
https://www.cell.com/cell-metabolism/pdf/S1550-4131(21)00482-4.pdf